Инженерные дисциплины / Материаловедение
Калькулятор по материаловедению
Введите условие задачи.
Задания описываются достаточно подробно и формализованно:
- вещественные числа оформляются через разделитель точку (например, 0.25).
- перед каждым показателем указывается его наименование, например, давления p2=0.5 МПа, температура t=50 C.
Пример
Найти дебройлевскую длину волны (в нонаметрах) молекул водорода, соответствующую их наиболее вероятной скорости при 323 К.Формализованное задание:
Найти дебройлевскую длину волны (в нонаметрах) молекул водорода, соответствующую их наиболее вероятной скорости при температуре 323 К.
Важно! Решение, полученное нейросетями AI могут содержать ошибки.
Примеры решения задач по материаловедению
Задание. Даны массы сплавленных веществ (в кг): Fe:1917.50; C:4.00; Mn:10.00; Si:5.40; Cr:5.00; Ni:5.00; S:0.80; P:0.70; Cu:5.00; As:1.6.Общая масса сплава равна 2000 кг.
Определить и записать химический состав сплава через концентрации его компонентов, выраженные в массовых процентах (мас.%). Определить класс материала (сталь, чугун, бронза, латунь, дюралюминий и т. п.), его назначение, качество, другие характеристики и зашифровать указанную информацию в виде марки материала по известным правилам.
Решение. Определение химического состава
Для определения массовой доли каждого компонента в сплаве, вычислим концентрацию каждого элемента в процентном соотношении от общей массы сплава.
Расчет массовой доли элементов: $$ \% = \frac{\text{вес элемента}}{\text{общая масса}} \times 100\% $$ Железо (Fe): $$ \frac{1917.5}{2000} \times 100\% = 95.875\% $$ Углерод (C): $$ \frac{4.00}{2000} \times 100\% = 0.2\% $$ Марганец (Mn): $$ \frac{10.00}{2000} \times 100\% = 0.5\% $$ Кремний (Si): $$ \frac{5.40}{2000} \times 100\% = 0.27\% $$ Хром (Cr): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Никель (Ni): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Сера (S): $$ \frac{0.80}{2000} \times 100\% = 0.04\% $$ Фосфор (P): $$ \frac{0.70}{2000} \times 100\% = 0.035\% $$ Медь (Cu): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Асбест (As): $$ \frac{1.60}{2000} \times 100\% = 0.08\% $$ Итоговый химический состав:
Анализ химического состава
По массовой доле углерода ($C = 0.2\%$) материал относится к сталям, поскольку содержание углерода менее $2\%$.
Определение типа стали. Материал содержит следующие легирующие элементы:
Назначение и качество. Стали такого типа используются преимущественно в машиностроении, строительстве, судостроении и автомобильной промышленности. Они обладают хорошей прочностью, пластичностью и коррозионной стойкостью.
Маркировка стали. Согласно ГОСТ 1050-88, марка стали обозначается следующим образом: $$ \text{Условная марка } = \text{углеродное число} $$ Поскольку массовая доля углерода составляет $0.2\%$, условная марка будет $20$.
Наиболее подходящей маркой будет
Для определения массовой доли каждого компонента в сплаве, вычислим концентрацию каждого элемента в процентном соотношении от общей массы сплава.
Расчет массовой доли элементов: $$ \% = \frac{\text{вес элемента}}{\text{общая масса}} \times 100\% $$ Железо (Fe): $$ \frac{1917.5}{2000} \times 100\% = 95.875\% $$ Углерод (C): $$ \frac{4.00}{2000} \times 100\% = 0.2\% $$ Марганец (Mn): $$ \frac{10.00}{2000} \times 100\% = 0.5\% $$ Кремний (Si): $$ \frac{5.40}{2000} \times 100\% = 0.27\% $$ Хром (Cr): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Никель (Ni): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Сера (S): $$ \frac{0.80}{2000} \times 100\% = 0.04\% $$ Фосфор (P): $$ \frac{0.70}{2000} \times 100\% = 0.035\% $$ Медь (Cu): $$ \frac{5.00}{2000} \times 100\% = 0.25\% $$ Асбест (As): $$ \frac{1.60}{2000} \times 100\% = 0.08\% $$ Итоговый химический состав:
| Компонент | Массовая доля, % |
| Fe | 95.875 |
| C | 0.2 |
| Mn | 0.5 |
| Si | 0.27 |
| Cr | 0.25 |
| Ni | 0.25 |
| S | 0.04 |
| P | 0.035 |
| Cu | 0.25 |
| As | 0.08 |
По массовой доле углерода ($C = 0.2\%$) материал относится к сталям, поскольку содержание углерода менее $2\%$.
Определение типа стали. Материал содержит следующие легирующие элементы:
- Марганец — до $1.7\%$ (легирующая сталь)
- Хром, никель, кобальт, молибден, ванадий отсутствуют
- Сера присутствует в количестве $0.04\%$, допустимо для конструкционных сталей
- Фосфор присутствует в количестве $0.035\%$/
Назначение и качество. Стали такого типа используются преимущественно в машиностроении, строительстве, судостроении и автомобильной промышленности. Они обладают хорошей прочностью, пластичностью и коррозионной стойкостью.
Маркировка стали. Согласно ГОСТ 1050-88, марка стали обозначается следующим образом: $$ \text{Условная марка } = \text{углеродное число} $$ Поскольку массовая доля углерода составляет $0.2\%$, условная марка будет $20$.
Наиболее подходящей маркой будет
Сталь 20.
Задание. Для марки стали 20 используя диаграмму состояния Fe–Fe3C, выполните следующие действия:
- определите фазовый состав при температуре T=1530 °С;
- опишите фазовые превращения, происходящие в стали при охлаждении до комнатной температуры, охарактеризуйте и схематически изобразите микроструктуру, которая сформируется при комнатной температуре;
- укажите значения критических точек Ас1, Ас3(Аcm) и температуру нагрева стали под закалку.
Решение. Рассмотрим марку стали 20 — это малоуглеродистая сталь с содержанием углерода около 0,20% (по массе). Для анализа используем диаграмму состояния Fe–Fe₃C (железо – цементит).
1) Фазовый состав при температуре T = 1530 °С.
При температуре 1530 °С сталь 20 находится выше линии ликвидуса на диаграмме Fe–Fe₃C.
Содержание углерода: 0,20%
2) Фазовые превращения при охлаждении до комнатной температуры.
Рассмотрим процесс охлаждения стали 20 от 1530 °С до комнатной температуры.
1. От 1530 °С до ~1490 °С:
3) Критические точки и температура нагрева под закалку.
Для стали 20 (доэвтектоидная сталь):
1) Фазовый состав при температуре T = 1530 °С.
При температуре 1530 °С сталь 20 находится выше линии ликвидуса на диаграмме Fe–Fe₃C.
Содержание углерода: 0,20%
- Линия ликвидуса для стали с 0,2% C пересекается при температуре около 1490–1495 °С.
- При 1530 °С > Tликвидус, сталь полностью жидкая.
2) Фазовые превращения при охлаждении до комнатной температуры.
Рассмотрим процесс охлаждения стали 20 от 1530 °С до комнатной температуры.
1. От 1530 °С до ~1490 °С:
- Охлаждение жидкости.
- При ~1490 °С достигается линия ликвидуса.
- Начинается кристаллизация: выделяются первые кристаллы аустенита (γ-Fe).
- Продолжается кристаллизация аустенита из жидкого раствора.
- Процесс идёт по линии ликвидус и солидус.
- При ~1420 °С (линия солидус) кристаллизация завершается.
- Структура: однородный аустенит (γ-Fe) с 0,20% C.
- Аустенит устойчив.
- При охлаждении до ~800 °С (пересечение линии GS на диаграмме Fe–Fe₃C) начинается выделение феррита (α-Fe) по границам зёрен аустенита.
- Углерод в феррите практически не растворяется (максимум ~0,02% при 727 °С), поэтому он вытесняется в оставшийся аустенит.
- Содержание углерода в аустените постепенно увеличивается до 0,8% при 727 °С.
- Аустенит с 0,8% C претерпевает перитектоидное превращение: $$ \gamma (0,8\% C) \rightarrow \alpha (0,02\% C) + Fe_3C \text{ (цементит)} $$
- Образуется перлит — механическая смесь феррита и цементита (пластинчатая структура). Феррит, выделившийся до 727 °С, остаётся как равновесный феррит.
- Феррит (основная фаза, ~75–80%)
- Перлит (~20–25%) — в виде зёрен или прослоек между зёрнами феррита.
- Феррит + перлит
- Феррит — светлые зёрна
- Перлит — тёмные зернистые или полосчатые включения
+-----------------------------+ | Феррит (светлые зёрна) | | +--------+ | | | Перлит | | | | (тёмный)| | | +--------+ | | | | Феррит | | +--------+ | | | Перлит | | | +--------+ | +-----------------------------+Микроструктура — равновесная, характерная для доэвтектоидной стали.
3) Критические точки и температура нагрева под закалку.
Для стали 20 (доэвтектоидная сталь):
- Ac₁ — температура начала превращения перлита в аустенит при нагреве. Ac₁ ≈ 727 °C (линия PSK)
- Ac₃ — температура полного превращения феррита в аустенит при нагреве. Для стали 20 (~0,2% C): Ac₃ ≈ 850–860 °C (по линии GS)
- Acm — не применимо, так как это для заэвтектоидных сталей (линия SE)
- Закалка стали 20 проводится в аустенитную область: нагрев выше Ac₃ на 30–50 °C для полного аустенитирования.
- Рекомендуемая температура нагрева: 880–900 °C
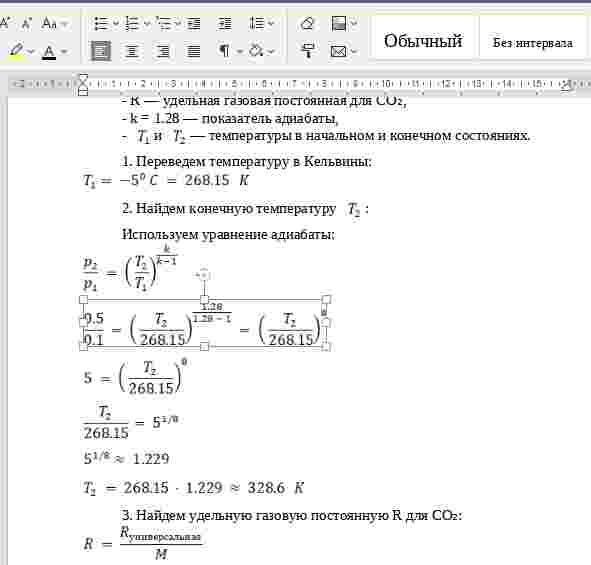
Задание. Масса сухого образца 76г. После насыщения образца водой его масса составляет 79г. Определить плотность и пористость камня, если водопоглащение по объему сто составляет 8,2%, а плотность твердого вещества равна 2,68 г/см3.
Решение.
Дано:
2. Водопоглощение по объему. По условию, водопоглощение по объему составляет 8,2%. Это означает, что объем воды, поглощенной образцом, составляет 8,2% от **общего объема образца**: \[ W_{\text{об}} = \frac{V_{\text{воды}}}{V_{\text{образца}}} \cdot 100\% = 8,2\% \] Отсюда найдем объем образца \( V \): \[ \frac{3}{V} = 0,082 \Rightarrow V = \frac{3}{0,082} \approx 36,5854 \, \text{см}^3 \]
3. Определим плотность камня (кажущуюся плотность).
Кажущаяся плотность — это отношение массы сухого образца к его общему объему (включая поры): \[ \rho_{\text{каж}} = \frac{m_{\text{сух}}}{V} = \frac{76}{36,5854} \approx 2,077 \, \text{г/см}^3 \]
4. Определим истинную плотность и пористость.
Истинная плотность — это плотность твердого вещества (дана): \( \rho_{\text{тв}} = 2,68 \, \text{г/см}^3 \)
Объем твердого вещества в образце: \[ V_{\text{тв}} = \frac{m_{\text{сух}}}{\rho_{\text{тв}}} = \frac{76}{2,68} \approx 28,3582 \, \text{см}^3 \] Общий объем образца: \( V = 36,5854 \, \text{см}^3 \)
Тогда объем пор: \[ V_{\text{пор}} = V - V_{\text{тв}} = 36,5854 - 28,3582 = 8,2272 \, \text{см}^3 \]
5. Пористость камня (в процентах от общего объема): \[ P = \frac{V_{\text{пор}}}{V} \cdot 100\% = \frac{8,2272}{36,5854} \cdot 100\% \approx 22,49\% \]
Проверка: водопоглощение по объему:
Мы использовали, что \( V_{\text{воды}} = 3 \, \text{см}^3 \), а \( V = 36,5854 \, \text{см}^3 \), тогда: \[ W_{\text{об}} = \frac{3}{36,5854} \cdot 100\% \approx 8,2\% — верно. \]
Ответ: Плотность камня (кажущаяся): 2,08 г/см3, Пористость: 22,5%.
Дано:
- Масса сухого образца: \( m_{\text{сух}} = 76 \, \text{г} \)
- Масса насыщенного водой образца: \( m_{\text{нас}} = 79 \, \text{г} \)
- Водопоглощение по объему: \( W_{\text{об}} = 8,2\% \)
- Плотность твердого вещества: \( \rho_{\text{тв}} = 2,68 \, \text{г/см}^3 \)
- Плотность камня (кажущуюся плотность)
- Пористость камня
2. Водопоглощение по объему. По условию, водопоглощение по объему составляет 8,2%. Это означает, что объем воды, поглощенной образцом, составляет 8,2% от **общего объема образца**: \[ W_{\text{об}} = \frac{V_{\text{воды}}}{V_{\text{образца}}} \cdot 100\% = 8,2\% \] Отсюда найдем объем образца \( V \): \[ \frac{3}{V} = 0,082 \Rightarrow V = \frac{3}{0,082} \approx 36,5854 \, \text{см}^3 \]
3. Определим плотность камня (кажущуюся плотность).
Кажущаяся плотность — это отношение массы сухого образца к его общему объему (включая поры): \[ \rho_{\text{каж}} = \frac{m_{\text{сух}}}{V} = \frac{76}{36,5854} \approx 2,077 \, \text{г/см}^3 \]
4. Определим истинную плотность и пористость.
Истинная плотность — это плотность твердого вещества (дана): \( \rho_{\text{тв}} = 2,68 \, \text{г/см}^3 \)
Объем твердого вещества в образце: \[ V_{\text{тв}} = \frac{m_{\text{сух}}}{\rho_{\text{тв}}} = \frac{76}{2,68} \approx 28,3582 \, \text{см}^3 \] Общий объем образца: \( V = 36,5854 \, \text{см}^3 \)
Тогда объем пор: \[ V_{\text{пор}} = V - V_{\text{тв}} = 36,5854 - 28,3582 = 8,2272 \, \text{см}^3 \]
5. Пористость камня (в процентах от общего объема): \[ P = \frac{V_{\text{пор}}}{V} \cdot 100\% = \frac{8,2272}{36,5854} \cdot 100\% \approx 22,49\% \]
Проверка: водопоглощение по объему:
Мы использовали, что \( V_{\text{воды}} = 3 \, \text{см}^3 \), а \( V = 36,5854 \, \text{см}^3 \), тогда: \[ W_{\text{об}} = \frac{3}{36,5854} \cdot 100\% \approx 8,2\% — верно. \]
Ответ: Плотность камня (кажущаяся): 2,08 г/см3, Пористость: 22,5%.
Задание. Определить выход сухой извести-кипелки из 20т известняка, содержащего 6% глинистых примесей.
Решение.
Дано:
\( M(\mathrm{CaCO_3}) = 40 + 12 + 48 = 100 \, \text{г/моль} = 0.1 \, \text{кг/моль} \)
\( M(\mathrm{CaO}) = 40 + 16 = 56 \, \text{г/моль} = 0.056 \, \text{кг/моль} \)
Шаг 3: Расчёт теоретического выхода CaO. Из уравнения реакции: \[ 100 \, \text{г CaCO₃} \to 56 \, \text{г CaO} \Rightarrow \text{выход} = \frac{56}{100} = 0.56 \] То есть из 1 кг чистого CaCO₃ получается 0.56 кг CaO. \[ m(\mathrm{CaO}) = 18\,800 \, \text{кг} \times 0.56 = 10\,528 \, \text{кг} \] Выход сухой извести-кипелки составляет 10,528 тонн.
Дано:
- Масса известняка: \( 20 \, \text{т} = 20\,000 \, \text{кг} \)
- Содержание глинистых примесей: \( 6\% \)
- Остальное — карбонат кальция (CaCO₃), предполагаем чистоту \( 94\% \)
- Химическая реакция обжига: \[ \mathrm{CaCO_3 \xrightarrow{\Delta} CaO + CO_2} \]
\( M(\mathrm{CaCO_3}) = 40 + 12 + 48 = 100 \, \text{г/моль} = 0.1 \, \text{кг/моль} \)
\( M(\mathrm{CaO}) = 40 + 16 = 56 \, \text{г/моль} = 0.056 \, \text{кг/моль} \)
Шаг 3: Расчёт теоретического выхода CaO. Из уравнения реакции: \[ 100 \, \text{г CaCO₃} \to 56 \, \text{г CaO} \Rightarrow \text{выход} = \frac{56}{100} = 0.56 \] То есть из 1 кг чистого CaCO₃ получается 0.56 кг CaO. \[ m(\mathrm{CaO}) = 18\,800 \, \text{кг} \times 0.56 = 10\,528 \, \text{кг} \] Выход сухой извести-кипелки составляет 10,528 тонн.
О дисциплине
Материаловедение – это междисциплинарная область науки, относящаяся к инженерным наукам, в частности, к прикладной физике и химии. Оно изучает свойства, структуру, производство и применение различных материалов. Материаловедение тесно связано с различными инженерными дисциплинами, такими как машиностроение, электротехника, строительство.Это прикладная наука, которая использует знания из фундаментальных наук (физики, химии, математики) для решения практических задач в промышленности и других отраслях.
Материаловедение изучает структуру, свойства, производство и применение материалов, включая металлы, полимеры, керамику, композиты и другие.
Оно играет ключевую роль в разработке новых материалов и технологий, необходимых для решения современных инженерных задач.
Материаловедение также занимается изучением поведения материалов в различных условиях эксплуатации, таких как высокие температуры, механические нагрузки, воздействие окружающей среды.
В целом, материаловедение можно рассматривать как мост между фундаментальными науками и инженерной практикой, обеспечивая возможность создания новых материалов с заданными свойствами для различных применений.